-
پنجشنبه, ۱۵ تیر ۱۴۰۲، ۰۹:۲۹ ب.ظ
-
۹۱
اثر کیتوزان بر هیدروژلهای هوشمند در دارورسانی برای درمان سرطان
چکیده
امروزه سرطان یک مشکل بهداشتی جهانی است و به یکی از علل اصلی مرگ و میر تبدیل شده است. گزینههای درمانی مختلفی برای بیماران مبتلا به سرطان با توجه به تشخیصها و مراحل مختلف تومور، از جمله جراحی، شیمی درمانی و... وجود داشته است؛ اما این درمانها دارای عوارض جانبی فراوانی مانند اثربخشی محدود و آسیب به اندامهای طبیعی هستند. از این رو، طراحی و ساخت سیستمهای جدید دارورسانی کارآمد و کم خطر برای درمان سرطان، توجه زیادی را به خود جلب کرده است. تجویز موضعی داروهای ضد سرطان با نیاز به دوز داروی کمتر و سمیت کمتر برای بافتهای غیر هدفمند مورد توجه قرار گرفته است؛ در این میان، هیدروژلهایی با شبکه سهبعدی میتوانند مقدار زیادی آب را جذب و در خود نگه دارند و میتوانند یک یا چند دارو را در شبکه سهبعدی متقابل محصور کنند. علاوه بر این، هیدروژلها میتوانند یک محیط مرطوب را در محل استفاده حفظ کنند و انتشار دارو را طولانیتر کنند و از انتشار آن به سایر مناطق سالم جلوگیری کنند؛ همچنین کیتوزان بعنوان یک پلیمر طبیعی به دلیل تطبیق زیستی خوب و سمیت کم و زیست تخریب پذیری به عنوان مادهای برای کاربردهای زیست پزشکی بکار میرود. در این تحقیق ضمن مطالعه انواع مختلف هیدروژلها، مشاهده شد هیدروژلهای مبتنی بر کیتوزان میتوانند نقش بارزی به عنوان یک راهبرد در دارورسانی هدفمند ایفا کنند.
کلمات کلیدی: هیدروژل، کیتوزان، سرطان، دارورسانی، تزریقی
مقدمه
سرطان یک مشکل بهداشتی جهانی است و به یکی از علل اصلی مرگ و میر تبدیل شده است. در حال حاضر، گزینههای درمانی مختلفی برای بیماران مبتلا به سرطان با توجه به تشخیصها و مراحل مختلف تومور، از جمله جراحی، شیمی درمانی و رادیوتراپی، و همچنین ایمونوتراپی جدید و درمان هدفمند مولکولی در دسترس است. برخی محدودیتها اجتناب ناپذیر هستند، مانند عوارض جانبی جدی مرتبط با درمان، اثربخشی محدود و آسیب به اندامهای طبیعی. . از این رو، طراحی و ساخت سیستمهای جدید دارورسانی کارآمد با درجه سمیت کم برای درمان سرطان، توجه فزایندهای را به خود جلب کرده است. تجویز موضعی داروهای ضد سرطان با نیاز به دوز داروی کمتر و سمیت کمتری برای بافتهای غیر هدفمند، در جهت ایجاد فرمولهای مختلفی برای توزیع مستقیم داروها در محل تومور، مانند ژلها، سوسپانسیونها، ذرات و فیلمها مورد بررسی قرار گرفتهاند. در این میان، هیدروژلهایی با شبکه سهبعدی میتوانند مقدار زیادی آب را جذب و در خود نگه دارند و میتوانند یک یا چند دارو را در شبکه سهبعدی متقابل محصور کنند. علاوه بر این، هیدروژلها میتوانند یک محیط مرطوب را در محل استفاده حفظ و انتشار دارو را طولانیتر کنند و از انتشار آن به سایر مناطق سالم جلوگیری کنند. در نتیجه، هیدروژلها به عنوان یک راهبرد موضعی دارورسانی موثر در نظر گرفته میشوند]1[. هیدروژلها شبکههای سهبعدی مبتنی بر پلیمرهای متقاطع، مولکولهای کوچک و کلوئید هستند که تعدادی از گروهها با حوزههای آبدوست مانند –OH، –CONH–، –CONH2– و –SO3H وجود دارند [2,3]. ظهور این گروه ها و حوزه ها مسئول جذب مقادیر زیادی آب و مایعات بیولوژیکی هستند و به حفظ بخش قابل توجهی از آب در ساختار آن کمک می کنند. هیدروژل ها همچنین دارای ویژگی های متعددی هستند که آنها را به یک کاندید عالی برای کاربردهای زیست پزشکی از جمله دارورسانی، ترمیم زخم، بازسازی بافت و سلول درمانی تبدیل میکند؛ همچنین هیدروژل های کاملا متورم در آب و مایعات فیزیولوژیکی نیز زیست سازگاری خوب، سمیت کم و زیست تخریب پذیری قابل قبولی از خود نشان میدهند. پلیمرهای مورد استفاده در آماده سازی هیدروژل نیز دارای خاصیت چسبندگی زیستی و مخاطی هستند که می توانند نفوذپذیری بافت و زمان ماندگاری دارو را افزایش دهند. ویژگی های نرم و الاستیک بودن دارو، ناراحتی و سوزشهای پس از جایگذاری دارو را به حداقل می رساند، همچنین کشش سطحی کم، چسبندگی سلولی و جذب پروتئین را به حداقل می رساند[3,4]. همچنین، به دلیل خواص بیومیمتیک یا زیست همانند سازی، هیدروژلها دو هدف را دنبال میکنند: آنها به عنوان ماده پشتیبان برای بازسازی بافت عمل میکنند و به تحویل محموله دارو با روش جذب یا کپسولهسازی کمک میکنند. هیدروژلها را میتوان با روش یک مرحلهای یا چند مرحلهای سنتز کرد. هیدروژل های "هوشمند" آنهایی هستند که می توانند به تغییرات کوچک در محرک های محیطی از جمله دما، pH، آنزیمها، نور، امواج فراصوت و میدانهای مغناطیسی پاسخ دهند. یک تغییر کوچک در محیط خارجی باعث تورم هیدروژل پاسخدهنده به محرکها میشود که منجر به آزاد شدن داروهای به دام افتاده با سرعت از پیش تعیین شده میشود. ساختار متخلخل میتواند انواع داروها را بارگیری کند و با تنظیم محیط داخلی و خارجی، می توان از هیدروژلهای هوشمند برای کنترل دارورسانی استفاده کرد[5]. در مقایسه با سایر هیدروژلها، هیدروژلهای تزریقی با پیوند متقابل سه بعدی به عنوان داربستهایی برای تحویل مولکولهای زیستی، توجه بیشتری را به خود جلب میکنند. اصطلاح "تزریق پذیر" به این معنی است که سل یا ژل را میتوان به وسیله یک دستگاه تزریق به محل مورد نظر منتقل کرد. بنابراین، می تواند در داخل بدن تشکیل شود. یک هیدروژل تزریقی برای کاربردهای زیست پزشکی از تعدادی معیار پیروی می کند: (الف) تشکیل یا تخریب ژل، (ب) عدم وجود معرفهای سمی، (ج) عدم تولید محصول سمی (د) خواص مکانیکی لازم پس از تزریق را نشان دهد]3[.
جدول 1. انواع هیدروژل[6]
|
مثال |
کاربرد |
خواص |
انواع هیدروژلها |
|
کیتوزان، سوکسینات صمغ گوار، کاپا کاراگینان، پلیاترایمید[1] ، پلی(آکریلیک اسید)[2] |
دارورسانی، حسگر، هیدروژلهای پاسخگو به التهاب، ترمیم زخم و پوست |
زیستسازگاری، رهایش پایدار داروهای ترکیب شده، افزایش آب دوستی و تورم، فعل و انفعالات الکترواستاتیک قوی و پایداری |
پاسخگو به pH |
|
پولوکسامر، پلورونیک، پلی (آکریلیک اسید)، گلیسروفسفات و متوکسی پلی(اتیلن گلیکول) - پلی(پیرولیدون کو لاکتید) |
دارورسانی، لنزهای داخل چشمی و مهندسی بافت |
خواص فیزیکی منحصر به فرد مشابه ماتریس خارج سلولی، عملکرد آسان با مولکولهای دارو و تخریب کنترل شده |
پاسخگو به دما |
|
آگارز، آلژینات کلسیم، کربومر، کندرویتین سولفات، اسید هیالورونیک و صمغ زانتان نیمه هیدرولیز شده |
دارورسانی، کرمها و سوسپانسیونها به عنوان تثبیتکننده امولسیون، در لوازم آرایشی به عنوان قوامدهنده و تثبیت کننده |
زیستسازگاری، حداقل تهاجم، آزادسازی کنترل شده محموله بسته به قدرت یا مدت زمان میدان الکتریکی اعمال شده |
پاسخگو به میدان الکتریکی |
|
پیوند متقابل آلژینات- زانتان با نانوذرات مغناطیسی +Ca2، هیدروژلهای همی سلولز با اکسید آهن مغناطیسی Fe3O4 |
دارورسانی، سنجش، میکروسیال و مهندسی بافت |
رفتار تورمی که به دما نیز پاسخ میدهد، برخی از آنها دارای خواص ناهمسانگرد، جذب موفق و رهایش کنترلشده داروها |
پاسخگو به میدان مغناطیسی |
|
هیدروژلهای کربوپل[3] حاوی دیکلوفناک- میکروسفرهای کیتوزان سدیم، مشتقات تری فنیل متان لوکو و تری سدیم کلروفیلین مس |
تحویل دارو، تحویل نوری، میکروسیال، خود استریلیزاسیون [4]و خود تمیز شوندگی |
انتشار کنترل، برگشتپذیر و غیرقابل برگشت، کنترل فضایی-زمانی بر گروههای عملکردی و متناسب با کاربرد تقویت میشود |
پاسخگو به نور |
|
انسولین |
دارورسانی، سیستم تحویل انسولین، کشت سلولی، حسگر و مهندسی بافت |
پاسخگو به آنزیم، شناخت مولکولی، میل ترکیبی بالا، ویژگی انتشار کنترل شده و زیست سازگاری |
پاسخگو به زیست مولکولها |
کیتوزان یک پلیمر طبیعی است و از طریق استیل زدایی قلیایی کیتین که دومین پلی ساکارید فراوان بعد از سلولز است و بیشتر در پوسته سخت پوستان یافت می شود، به دست میآید. با گذشت زمان، چندین ویژگی منحصر به فرد کیتوزان از جمله زیست سازگاری، سمیت کم و فعالیت ضدمیکروبی متوسطی از خود نشان میدهد. این ویژگی منجر به کاربردهای متعدد کیتوزان در زمینه زیست پزشکی به عنوان جایگزینهای زیستی، پانسمانهای زخم، ضد باکتریها و حاملهای دارو شده است. با توجه به ویژگیهای سودمند آن، استفاده از کیتوزان به عنوان هیدروژلهای تزریقی، به ویژه در سیستمهای دارورسانی نسل جدید، توصیه میشود[7,8].
کیتوزان را میتوان در داربستهای مختلف برای تحویل دارو به سادگی با اصلاح بخشهای ساختاری و عملکردی آن ساخت؛ در نتیجه، کیتوزان دارای طیف گستردهای از کاربرد در پزشکی و دارورسانی است[2,9]. هیدروژل کیتوزان برای تحویل پروتئینها، پپتیدها، آنتیژنها، ژنها و الیگونوکلئوتیدها مناسب است و میتواند در سیستمهای دارورسانی جدیدتری طراحی شود که بارهای خود را در پاسخ به محرکهای محیطی مختلف آزاد میکنند. به دلیل وجود گروه نیتروژن در ساختار مولکولی آن (شکل 1)، کیتوزان ماهیت کاتیونی دارد و تمایل به تشکیل کمپلکسهای پلی الکترولیت را نشان میدهد. کیتوزان بیشتر ویژگیهای عملکردی مانند چسبندگی مخاطی، انتقال ژن و ژلسازی را نشان میدهد که به اسیدهای آمینه اولیه متصل به زنجیرههای پلیمری نسبت داده میشود. ماهیت کاتیونی کیتوزان به تشکیل نمکهای کربوکسیلات مانند لاکتات، استات، سیترات و غیره کمک می کند که داربست ها را در آب محلول کند[2,10,11].
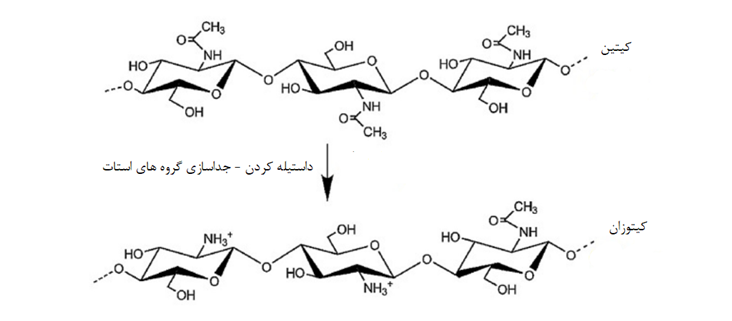
شکل 1. تبدیل کیتین به کیتوزان[2]
پردازش داربستهای مبتنی بر کیتوزان را میتوان با تحریک فیزیکی یا از طریق واکنشهای شیمیایی تسهیل کرد. در شرایط اسیدی آمینهای آلیفاتیک اولیه پروتونه میشوند. گروههای آمینه آزاد کیتوزان با یونهای هیدروژن در pH پایینتر برهمکنش میکنند و خواص مکانیکی را از طریق برهمکنش با پلیمرهای دیگر افزایش میدهند. کیتوزان و مشتقات آن را می توان به اشکال مختلف مانند هیدروژل، اسفنج، نانوذرات و غیره پردازش کرد[12,13].
کیتوزان در دارورسانی هوشمند
کیتوزان و مشتقات آن به طور طبیعی دارای حساسیتpH، زیست سازگاری خوب، زیست تخریب پذیری آنزیمی و ماهیت چند کاتیونی هستند. ترکیب پلیمرهای مختلف با کیتوزان و پروتونه شدن یا پروتونه زدایی گروه آمینه باعث افزایش واکنش به pH هیدروژلهای تزریقی مبتنی بر کیتوزان می شود. زنجیرههای پلیمری در pH پایینتر میتوانند به راحتی برای بهبود حلالیت در آب با پروتونه کردن گروه آمینه که باعث دافعه الکترواستاتیکی میشود، منبسط شوند، در حالی که pH بالاتر حلالیت کیتوزان در آب را با پروتونهزدایی گروه آمینه کاهش میدهد که باعث اختلال در ساختار کروی میشود. بنابراین، برای این مورد، خاصیت تورم و حلالیت در آب به مقدار pKa و شرایط pH خارجی بستگی دارد. علاوه بر این، در محلول های خنثی و قلیایی، کیتوزان حلالیت و عملکرد مکانیکی ضعیفی را نشان میدهد. ترکیب پلیمرهای مختلف با کیتوزان میتواند ویژگیهای پاسخدهی به pH را بهبود بخشد. به عنوان مثال، استفاده از بی کربنات سدیم به عنوان عامل ژل کننده در کیتوزان-هیدروکسی آپاتیت، امکان ژل شدن سریع در عرض 4 دقیقه را فراهم میکند که زنده ماندن، تکثیر و پراکندگی خوبی را به عنوان یک حامل سلولی نشان میدهد[2,14]. از طریق ترکیب کیتوزان و کلسیم فسفات آمورف برای ایجاد یک سیستم هیدروژل کامپوزیتی که در آن از اسیدی کننده گلوکونو لاکتون برای دستیابی به هیدروژل تزریقی پاسخگو به pH با زیست سازگاری خوب و همچنین چسبندگی و تکثیر سلولی موثر استفاده می شود . دما یکی از عوامل متعددی است که باعث تشکیل هیدروژلهای تزریقی میشود. ترکیب پلیمرهای پاسخگو به حرارت عموماً مسئول تهیه هیدروژلهای هوشمند مبتنی بر کیتوزان است. یک ماده تزریقی مطلوب مبتنی بر کیتوزان که به گرما پاسخگو است، انتقال سل-ژل را با تغییر دما نشان میدهد، یعنی مایع در دمای اتاق و انتقال فاز در دمای فیزیولوژیکی آغاز میشود. هیدروژلهای تزریقی مبتنی بر کیتوزان بهدلیل ویژگیهایی مثل همانند سازی، زیستسازگاری خوب و زیستتخریبپذیری، کاربردهایی را در مهندسی بافت مانند افزایش تشکیل بافت استخوان و همچنین فعالیت سلولی ارائه میکنند. اولین هیدروژل تزریقی پاسخگوی حرارتی با استفاده از (β-گلیسروفسفات) و کیتوزان باعث تشکیل ماتریکس شد و این کارایی دارو را افزایش میدهد و زمان نگهداری دارو را طولانیتر میکند. این هیدروژل های تزریقی دارای دمای انتقال سل-ژل در 37 درجه سانتیگراد هستند و می توان از آنها برای تحویل فاکتورهای رشد، داروهای کوچک، اسید نوکلئیک و سلولها استفاده کرد. هیدروژلهای پاسخگو به نور نیز به دلیل مزایایی که در تحویل فوری، کنترل از راه دور و عدم آسیب دارند، در زمینه دارورسانی مورد توجه قرار گرفته اند[2,15,16,17].
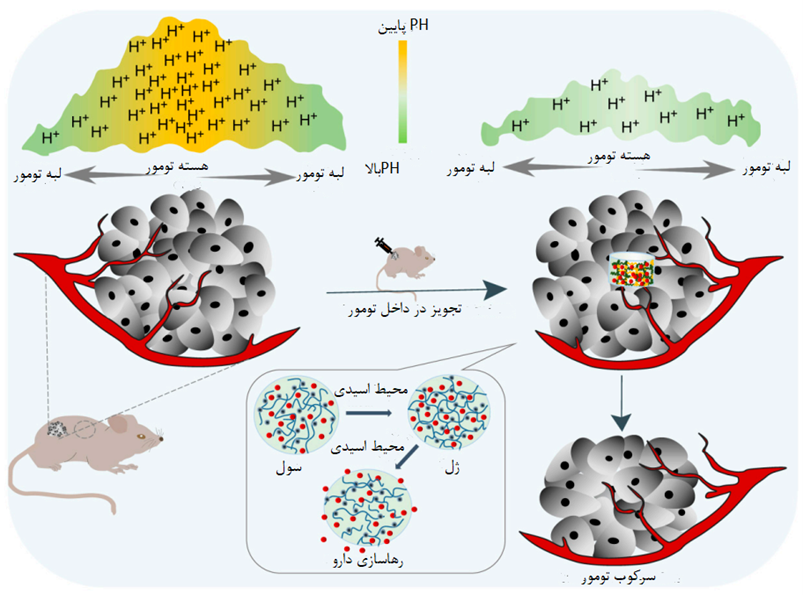
شکل 2. هیدروژل پاسخگو به pH محیط اسیدی تومور را کاهش میدهد و مهار رشد تومور را افزایش میدهد [1]
هیدروژلهای تزریقی کیتوزان حاوی داروهایی مانند آموکسی سیلین و ایبوپروفن میتوانند محمولههای خود را بر اثر تحریک میدانهای الکتریکی یا تغییر pH آزاد کنند. آنها همچنین به عنوان کاندیدای ایده آل برای تحویل هوشمند دارو در درمان ضد باکتریایی در نظر گرفته میشوند [18]. در شیمی درمانی، اثرات نامطلوب هیدروژلهای تزریقی با کنترل سرعت آزادسازی دارو و همچنین بارگذاری، تخریب و رفتار تورم هیدروژلها کاهش میابد. برای تحویل عوامل درمانی در محلهای خاص، انتظار میرود هیدروژلهای تزریقی نقش بیشتری در مقایسه با هیدروژلهای معمولی ایفا کنند. علاوه بر این، هیدروژلهای تزریقی نیز به عنوان حامل یا داربست برای تحویل سلولها یا بخشهای زیست فعال مانند آنزیمها، پروتئینها و غیره استفاده میشوند. مطالعات اخیر بر روی هیدروژلهای تزریقی نشان دهنده گیر افتادن بالای دارو است و می تواند برای درمان انواع مختلف سرطان و همچنین درمان موثر بر دیابت و عفونت میکروبی استفاده شود[19]. هیدروژلهای حساس به حرارت دارای دمای محلول بحرانی هستند که در آن از فاز محلول به فاز ژل تبدیل میشوند. پلیمرها را میتوان در حالت مایع به بدن تزریق کرد و به دنبال آن در دمای فیزیولوژیکی بدن، ژل میشود تا یک هیدروژل متقاطع در دمای محلول بهینه ایجاد شود. سیستم ما نه تنها رشد تومور را مهار میکند، بلکه اندازه آن را تا مرحله طبیعی کاهش میدهد. نتایج بهدستآمده با کاهش نشانگرهای تومور در خون تأیید شد و بیان میکند که تزریق موضعی سیستم هیدروژل اصلاحشده میتواند به طور قابلتوجهی رشد تومور را از یک طرف مهار کند و از عوارض جانبی مورد انتظار دارو جلوگیری کند. در نتیجه، ممکن است به عنوان یک رویکرد امیدوارکننده و کارآمد برای دستیابی به گسترش پایدار ضد سرطان شناخته شود[20].
نتیجهگیری
اخیراً هیدروژل های تزریقی مبتنی بر کیتوزان به عنوان یک پلت فرم موفق برای تحویل دارو ظاهر شده اند. کیتوزان یک پلیمر طبیعی است و به دلیل تطبیق زیستی خوب و سمیت کم و زیست تخریب پذیری به عنوان ماده ای برای کاربردهای زیست پزشکی بکار میرود. از این رو کیتوزان به طور گسترده برای طراحی مواد زیستی نسل جدید، در اشکال مختلف فیزیکی مانند نانوذرات، فیلمها، اسفنجها و هیدروژلها مورد بررسی قرار میگیرد. هیدروژل های مبتنی بر کیتوزان را میتوان برای تحویل داروها، پروتئینها، ژنها، آنتی ژنها و غیره استفاده کرد. این سیستم میتواند جهت مقابله و درمان سرطان بسیار موثر باشد و با نفوذ کنترل شده دارو، رشد تومور را بطور قابل توجهی مهار کند و عوارض جانبی دارو را به حداقل برساند. در نتیجه میتواند به عنوان یک رویکرد امیدوار کننده و کارآمد برای درمان سرطان تلقی شود.
پاورقی
[1] Polyether Imide
[2] PAA
[3] نام تجاری پلی(آکریلیک اسید)
[4] self-sterilization
نویسندگان مقاله
زهرا انصاری
کارشناسی ارشد مهندسی پلیمر-فراورش، دانشگاه اراک
امیر کشاورز
کارشناسی مهندسی پلیمر، مرکز آموزش عالی فنی مهندسی بویین زهرا
منابع
[1] Zhao, J., Wang, L., Zhang, H., Liao, B., & Li, Y. (2022). Progress of Research in In Situ Smart Hydrogels for Local Antitumor Therapy: A Review. Pharmaceutics, 14(10), 2028.
[2] M. Hamidi, A. Azadi, P. Rafiei, Hydrogel nanoparticles in drug delivery, Adv. Drug Deliv. Rev. 60 (2008) 1638–1649.
[3] Singha, Ishita, and Aalok Basu. "Chitosan based injectable hydrogels for smart drug delivery applications." Sensors International 3 (2022): 100168.
[4] C.A. Dreiss, Hydrogel design strategies for drug delivery, Curr. Opin. Colloid Interface Sci. 48 (2020) 1–17, https://doi.org/10.1016/j.cocis.2020.02.001.
[5] U. Ahmad, M. Sohail, M. Ahmad, M.U. Minhas, S. Khan, Z. Hussain, M. Kousar, S. Mohsin, M. Abbasi, S.A. Shah, Chitosan based thermosensitive injectable hydrogels for controlled delivery of loxoprofen: development, characterization and in-vivo evaluation, Int. J. Biol. Macromol. 129 (2019) 233–245.
[6] Bordbar-Khiabani, A., & Gasik, M. (2022). Smart hydrogels for advanced drug delivery systems. International Journal of Molecular Sciences, 23(7), 3665.
[7] A.K. Nayak, M.S. Hasnain, Plant Polysaccharides in Drug Delivery Applications, 2019, pp. 19–23, https://doi.org/10.1007/978-981-10-6784-6_2.
[8] S. Jana, A. Saha, A.K. Nayak, K.K. Sen, S.K. Basu, Aceclofenac-loaded chitosantamarind seed polysaccharide interpenetrating polymeric network microparticles, Colloids Surf. B Biointerfaces 105 (2013) 303–309, https://doi.org/10.1016/ j.colsurfb.2013.01.013.
[9] B. Abinaya, T.P. Prasith, B. Ashwin, S. Viji Chandran, N. Selvamurugan, Chitosan in surface modification for bone tissue engineering applications, Biotechnol. J. 14 (2019) 1900171.
[10] A. Oryan, S. Sahvieh, Effectiveness of chitosan scaffold in skin, bone and cartilage healing, Int. J. Biol. Macromol. 104 (2017) 1003–1011, https://doi.org/10.1016/ j.ijbiomac.2017.06.124.
[11] M.T. Ansari, S. Murteza, M.N. Ahsan, M.S. Hasnain, A.K. Nayak, Chitosan as a responsive biopolymer in drug delivery, in: Chitosan Drug Deliv, Elsevier, 2022, pp. 389–410, https://doi.org/10.1016/B978-0-12-819336-5.00002-9.
[12] K. Lavanya, S.V. Chandran, K. Balagangadharan, N. Selvamurugan, Temperatureand pH-responsive chitosan-based injectable hydrogels for bone tissue engineering, Mater. Sci. Eng. C 111 (2020) 110862.
[13] B. Ding, H. Gao, J. Song, Y. Li, L. Zhang, X. Cao, M. Xu, J. Cai, Tough and cellcompatible chitosan physical hydrogels for mouse bone mesenchymal stem cells in vitro, ACS Appl. Mater. Interfaces 8 (2016) 19739–19746.
[14] A. Rogina, A. Ressler, I. Matic, G.G. Ferrer, I. Marijanovic, M. Ivankovic, H. Ivankovic, Cellular hydrogels based on pH-responsive chitosan-hydroxyapatite system, Carbohydr. Polym. 166 (2017) 173–182.
[15] W.M. Argüelles-Monal, J. Lizardi-Mendoza, D. Fernandez-Quiroz, M.T. RecillasMota, M. Montiel-Herrera, Chitosan derivatives: introducing new functionalities with a controlled molecular architecture for innovative materials, Polymers (Basel) 10 (2018) 342.
[16] J. Qu, X. Zhao, P.X. Ma, B. Guo, pH-responsive self-healing injectable hydrogel based on N-carboxyethyl chitosan for hepatocellular carcinoma therapy, Acta Biomater. 58 (2017) 168–180.
[17] A. Chenite, C. Chaput, D. Wang, C. Combes, M.D. Buschmann, C.D. Hoemann, J.C. Leroux, B.L. Atkinson, F. Binette, A. Selmani, Novel injectable neutral solutions of chitosan form biodegradable gels in situ, Biomaterials 21 (2000) 2155–21
[18] J. Qu, X. Zhao, P.X. Ma, B. Guo, Injectable antibacterial conductive hydrogels with dual response to an electric field and pH for localized “smart” drug release, Acta Biomater. 72 (2018) 55–69, https://doi.org/10.1016/j.actbio.2018.03.018.
[19] R. Xing, K. Liu, T. Jiao, N. Zhang, K. Ma, R. Zhang, Q. Zou, G. Ma, X. Yan, An injectable self-assembling collagen–gold hybrid hydrogel for combinatorial antitumor photothermal/photodynamic therapy, Adv. Mater. 28 (2016) 3669–3676.
[20] Abdellatif, A. A., Mohammed, A. M., Saleem, I., Alsharidah, M., Al Rugaie, O., Ahmed, F., & Osman, S. K. (2022). Smart injectable chitosan hydrogels loaded with 5-fluorouracil for the treatment of breast cancer. Pharmaceutics, 14(3), 661.














